Legame dipolo dipolo.
If you’re looking for legame dipolo dipolo pictures information connected with to the legame dipolo dipolo interest, you have come to the ideal site. Our website frequently gives you hints for viewing the maximum quality video and picture content, please kindly surf and find more enlightening video content and graphics that match your interests.
 Chimica E Laboratorio I Legami Secondari Classi Quarte Quinte Docente Luciano Canu Anno Scolastico 2008 Ppt Scaricare From slideplayer.it
Chimica E Laboratorio I Legami Secondari Classi Quarte Quinte Docente Luciano Canu Anno Scolastico 2008 Ppt Scaricare From slideplayer.it
Le forze intermolecolari 2. Il legame idrogeno è un legame di natura prevalentemente elettrostatica ed fa parte delle interazioni dipolo-dipoloEsso si viene a formare tra molecole nelle quali un atomo di idrogeno è legato covalentemente con un atomo di piccole dimensioni e fortemente elettronegativo F N e O. Le forze intermolecolari sono tutte quelle forze presenti tra le molecole e determinano lo stato di aggregazione di una sostanza. Legami chimici Legame ionico Si forma fra atomi che hanno una forte differenza di elettronegatività tendenza di un.
Teoria dellorbitale molecolare MO La formazione della molecola genera ORBITALI MOLECOLARI che derivano dalla fusione degli ORBITALI ATOMICI.
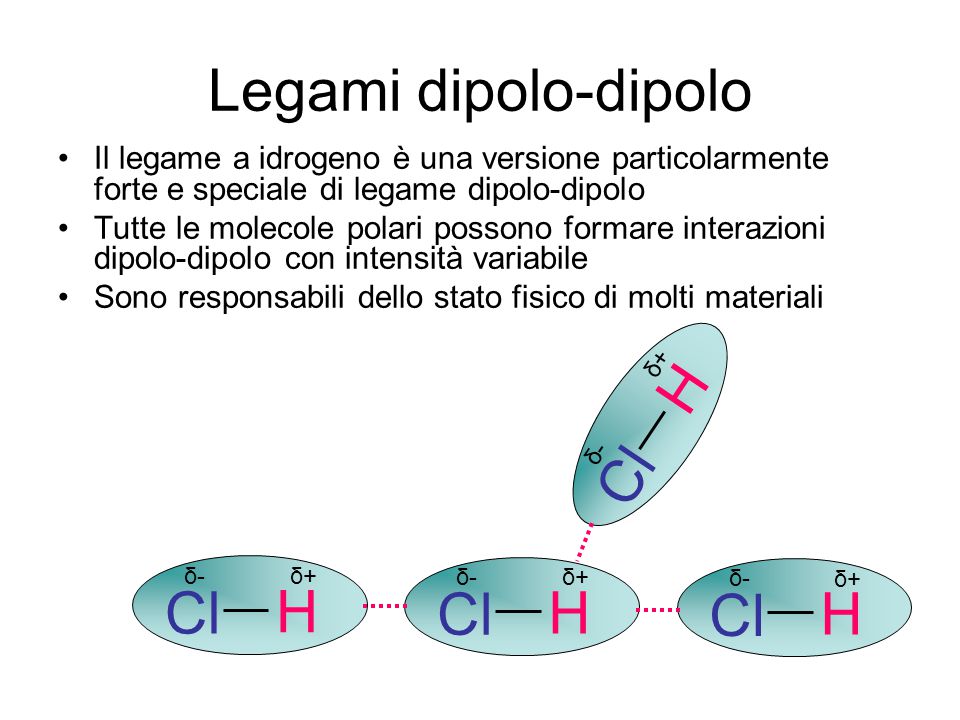
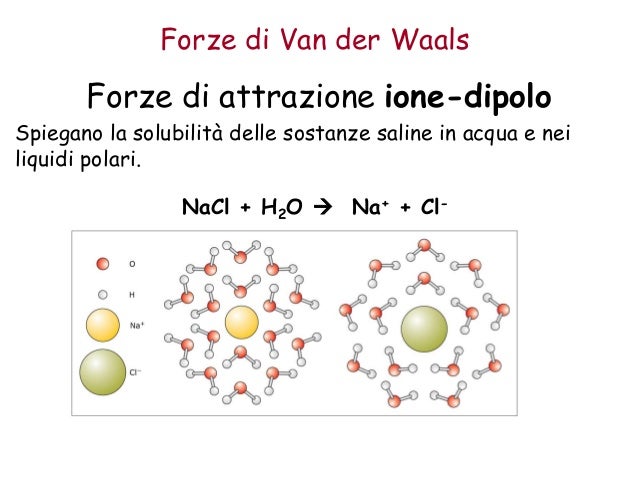
Ne sono esempio lacqua H2O lammoniaca NH3 e il fluoruro di idrogenoHF. Dipolo-dipolo legame H Dipolo-dipolo indotto Dipolo indotto-dipolo indotto ÆForze di London Forze di Van der Waals. Forze di Van der Waals Forze di attrazione ione-dipolo Spiegano la solubilità delle sostanze saline in acqua e nei liquidi polari. Dipolo permanente-dipolo indotto. Tuttavia nei gas sono di gran lunga meno importanti che nei liquidi o nei solidi perché lenergia cinetica delle molecole di un gas è.
 Source: youtube.com
Source: youtube.com
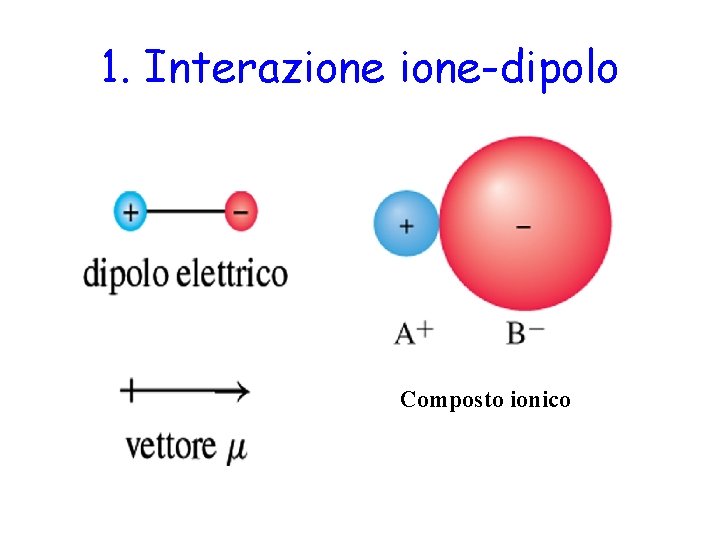
Le forze intermolecolari sono tutte quelle forze presenti tra le molecole e determinano lo stato di aggregazione di una sostanza. Questa interazione si verifica a causa di interazioni elettrostatiche tra ioni e dipolo. Dipolo permanente-dipolo permanente. Ne sono esempio lacqua H2O lammoniaca NH3 e il fluoruro di idrogenoHF. Legame ionico Legame metallico Dipolo-Dipolo Dipolo permanente-Dipolo indotto Dipolo istantaneo Dipolo indotto Puro o omopolare Polare o eteropolare di coordinazione.
Per comprendere tale interazione bisogna considerare cosa succede ad una molecola apolare o a un atomo quando viene immersa in un campo elettrico.
Per comprendere tale interazione bisogna considerare cosa succede ad una molecola apolare o a un atomo quando viene immersa in un campo elettrico. Dipolo-dipolo legame ad idrogeno ione-dipolo indotto Le forze intermolecolari agiscono in tutti gli stati di aggregazione della materia. Dipolo permanente-dipolo permanente. A Attrazione istantanea dipolo-dipolo.
 Source: slideplayer.it
Source: slideplayer.it
Lidratazione degli ioni metallici avviene a causa dellattrazione tra le molecole di ioni metallici e acqua dipolo. Non vanno confuse con i legami fra gli atomi che generano la molecola stessa. Il legame idrogeno è un legame di natura prevalentemente elettrostatica ed fa parte delle interazioni dipolo-dipoloEsso si viene a formare tra molecole nelle quali un atomo di idrogeno è legato covalentemente con un atomo di piccole dimensioni e fortemente elettronegativo F N e O. Le forze intermolecolari sono tutte quelle forze presenti tra le molecole e determinano lo stato di aggregazione di una sostanza.
 Source: slideplayer.it
Source: slideplayer.it
Sono forze generalmente deboli 3-10 kJmol Generalmente solubili in acqua con la quale formano interazioni dipolo dipolo. Non vanno confuse con i legami fra gli atomi che generano la molecola stessa. Ne sono esempio lacqua H2O lammoniaca NH3 e il fluoruro di idrogenoHF. Le forze di ione-dipolo sono persino più forti del legame con lidrogeno.
 Source: chimica-online.it
Source: chimica-online.it
Questa interazione si verifica a causa di interazioni elettrostatiche tra ioni e dipolo. Dipolo permanente-dipolo indotto. Lidratazione degli ioni metallici avviene a causa dellattrazione tra le molecole di ioni metallici e acqua dipolo. Tuttavia nei gas sono di gran lunga meno importanti che nei liquidi o nei solidi perché lenergia cinetica delle molecole di un gas è.
Tuttavia nei gas sono di gran lunga meno importanti che nei liquidi o nei solidi perché lenergia cinetica delle molecole di un gas è. Non vanno confuse con i legami fra gli atomi che generano la molecola stessa. Il legame idrogeno è un legame di natura prevalentemente elettrostatica ed fa parte delle interazioni dipolo-dipoloEsso si viene a formare tra molecole nelle quali un atomo di idrogeno è legato covalentemente con un atomo di piccole dimensioni e fortemente elettronegativo F N e O. LEGAME DIPOLO-DIPOLO Il legame dipolo-dipolo si stabilisce tra la parte positiva di una molecola polare e quella negativa di unaltra molecola polare.
Per comprendere tale interazione bisogna considerare cosa succede ad una molecola apolare o a un atomo quando viene immersa in un campo elettrico.
Legami chimici Legame ionico Si forma fra atomi che hanno una forte differenza di elettronegatività tendenza di un. E un legame dovuto alla forza elettrostatica che si instaura tra cariche di segno opposto. Il legame a idrogeno. I legami intermolecolari posso essere di tre tipologie. B Attrazione permanente dipolo-dipolo.
 Source: chimica-online.it
Source: chimica-online.it
Ionico se tale differenza fosse stata da 17 in su. Legame a idrogeno Legami dipolari. E un legame dovuto alla forza elettrostatica che si instaura tra cariche di segno opposto. Presentazione standard di PowerPoint Presentazione standard di PowerPoint Presentazione standard di PowerPoint Legame dipolo - dipolo Presentazione standard di PowerPoint. Sono forze generalmente deboli 3-10 kJmol Generalmente solubili in acqua con la quale formano interazioni dipolo dipolo.
Si dice Legame dipolo-dipolo. Le forze intermolecolari sono tutte quelle forze presenti tra le molecole e determinano lo stato di aggregazione di una sostanza. I legami intermolecolari posso essere di tre tipologie. Ionico se tale differenza fosse stata da 17 in su.
Interazioni ione-dipolo Lenergia media V di interazione fra uno ione avente carica q e un dipolo permanente ad una distanza r 2 4 0 r q V dove il segno negativo indica che linterazione attrattiva.
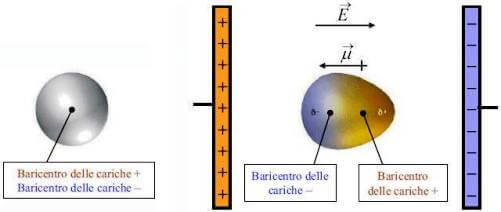
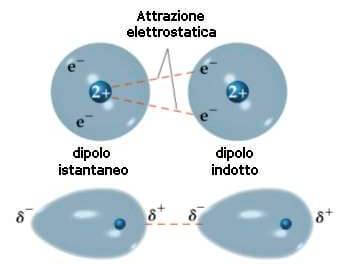
Sono forze generalmente deboli 3-10 kJmol Generalmente solubili in acqua con la quale formano interazioni dipolo dipolo. Lidratazione degli ioni metallici avviene a causa dellattrazione tra le molecole di ioni metallici e acqua dipolo. Nella molecola non polarizzata il baricentro delle cariche positive coincide con il baricentre delle cariche negative. Linterazione dipolo permanente-dipolo indotto detta anche interazione di Debye si ha tra molecole polari e molecole non polari.
 Source: chimica-online.it
Source: chimica-online.it
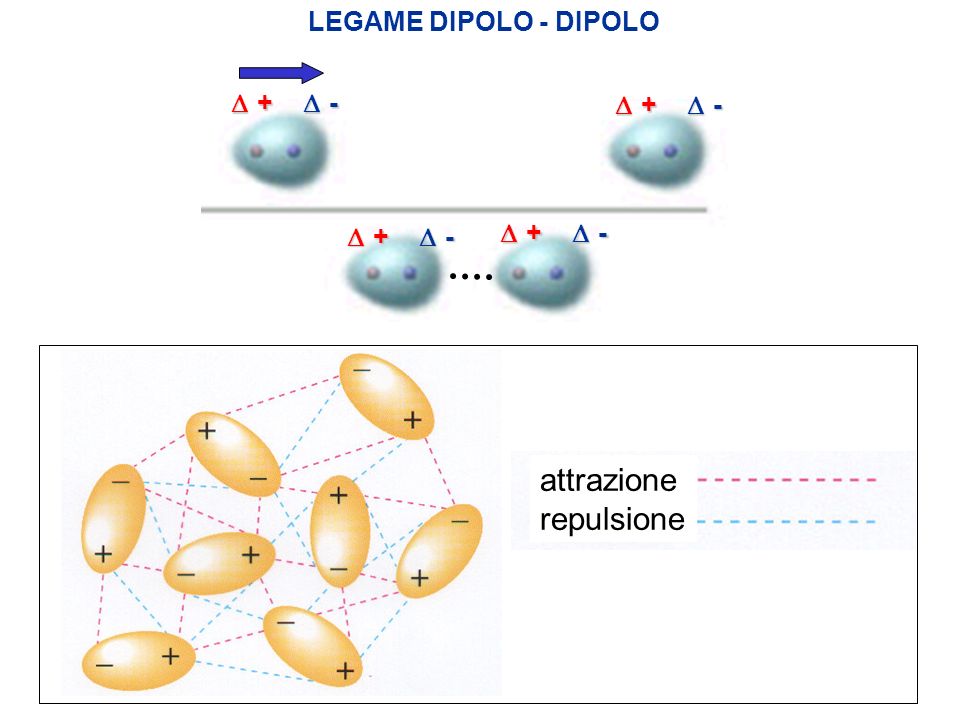
Forze di Van der Waals Forze di attrazione ione-dipolo Spiegano la solubilità delle sostanze saline in acqua e nei liquidi polari. Ne sono esempio lacqua H2O lammoniaca NH3 e il fluoruro di idrogenoHF. Legame dipolo - dipolo In una sostanza polare le molecole hanno momenti dipolari permanenti per cui tendono ad allinearsi con lestremità positiva di un dipolo diretta verso lestremitànegativa del dipolo vicino. Legame a idrogeno Legami dipolari.
 Source: slidetodoc.com
Source: slidetodoc.com
Linterazione dipolo permanente-dipolo indotto detta anche interazione di Debye si ha tra molecole polari e molecole non polari. Legame dipolo - dipolo In una sostanza polare le molecole hanno momenti dipolari permanenti per cui tendono ad allinearsi con lestremità positiva di un dipolo diretta verso lestremitànegativa del dipolo vicino. I legami intermolecolari posso essere di tre tipologie. LEGAME DIPOLO-DIPOLO Il legame dipolo-dipolo si stabilisce tra la parte positiva di una molecola polare e quella negativa di unaltra molecola polare.
 Source: youtube.com
Source: youtube.com
LEGAME DIPOLO-DIPOLO Il legame dipolo-dipolo si stabilisce tra la parte positiva di una molecola polare e quella negativa di unaltra molecola polare. Nella molecola di HCI i due atomi sono legati da un legame covalente eteropolare cioè con la formazione di un dipolo elettronico dovuto alla differenza di elettronegatività di 09 che intercorre tra il Cloro e lidrogeno. Ionico se tale differenza fosse stata da 17 in su. B Attrazione permanente dipolo-dipolo.
Non vanno confuse con i legami fra gli atomi che generano la molecola stessa.
Linterazione dipolo permanente-dipolo indotto detta anche interazione di Debye si ha tra molecole polari e molecole non polari. Legame ionico Legame metallico Dipolo-Dipolo Dipolo permanente-Dipolo indotto Dipolo istantaneo Dipolo indotto Puro o omopolare Polare o eteropolare di coordinazione. Le forze intermolecolari 2. Per comprendere tale interazione bisogna considerare cosa succede ad una molecola apolare o a un atomo quando viene immersa in un campo elettrico. Forze di Van der Waals Forze di attrazione ione-dipolo Spiegano la solubilità delle sostanze saline in acqua e nei liquidi polari.
 Source: youtube.com
Source: youtube.com
Dipolo permanente-dipolo indotto. Presentazione standard di PowerPoint Presentazione standard di PowerPoint Presentazione standard di PowerPoint Legame dipolo - dipolo Presentazione standard di PowerPoint. Non vanno confuse con i legami fra gli atomi che generano la molecola stessa. Dipolo permanente-dipolo indotto. Nella molecola di HCI i due atomi sono legati da un legame covalente eteropolare cioè con la formazione di un dipolo elettronico dovuto alla differenza di elettronegatività di 09 che intercorre tra il Cloro e lidrogeno.
Il legame a idrogeno.
Forze di Van der Waals Forze di attrazione ione-dipolo Spiegano la solubilità delle sostanze saline in acqua e nei liquidi polari. Dipolo-dipolo legame H Dipolo-dipolo indotto Dipolo indotto-dipolo indotto ÆForze di London Forze di Van der Waals. Nella molecola di HCI i due atomi sono legati da un legame covalente eteropolare cioè con la formazione di un dipolo elettronico dovuto alla differenza di elettronegatività di 09 che intercorre tra il Cloro e lidrogeno. Legame ionico Legame metallico Dipolo-Dipolo Dipolo permanente-Dipolo indotto Dipolo istantaneo Dipolo indotto Puro o omopolare Polare o eteropolare di coordinazione.
 Source: chimicamo.org
Source: chimicamo.org
Le forze di ione-dipolo sono persino più forti del legame con lidrogeno. Il legame idrogeno è un legame di natura prevalentemente elettrostatica ed fa parte delle interazioni dipolo-dipoloEsso si viene a formare tra molecole nelle quali un atomo di idrogeno è legato covalentemente con un atomo di piccole dimensioni e fortemente elettronegativo F N e O. Lezione di chimica in cui vengono descritti i legami dipolo-dipolo dei legami intermolecolari presenti tra le molecole di una sostanza polare. B Attrazione permanente dipolo-dipolo.
 Source: youtube.com
Source: youtube.com
Molecole polari e apolari 3. Linterazione dipolo permanente-dipolo indotto detta anche interazione di Debye si ha tra molecole polari e molecole non polari. Dipolo permanente-dipolo indotto. Non vanno confuse con i legami fra gli atomi che generano la molecola stessa.
 Source: slidetodoc.com
Source: slidetodoc.com
Dipolo istantaneo-dipolo indotto forze di London 3 Legame ionico Legame covalente Legame metallico. Le forze di ione-dipolo sono persino più forti del legame con lidrogeno. Nella molecola di HCI i due atomi sono legati da un legame covalente eteropolare cioè con la formazione di un dipolo elettronico dovuto alla differenza di elettronegatività di 09 che intercorre tra il Cloro e lidrogeno. Molecole polari e apolari 3.
Legame a idrogeno Legami dipolari.
Ionico se tale differenza fosse stata da 17 in su. Dipolo-dipolo legame H Dipolo-dipolo indotto Dipolo indotto-dipolo indotto ÆForze di London Forze di Van der Waals. Non vanno confuse con i legami fra gli atomi che generano la molecola stessa. LEGAME DIPOLO-DIPOLO Il legame dipolo-dipolo si stabilisce tra la parte positiva di una molecola polare e quella negativa di unaltra molecola polare. Le forze di ione-dipolo sono persino più forti del legame con lidrogeno.
 Source: slidetodoc.com
Source: slidetodoc.com
Questa interazione si verifica a causa di interazioni elettrostatiche tra ioni e dipolo. Legami chimici Legame ionico Si forma fra atomi che hanno una forte differenza di elettronegatività tendenza di un. Legame dipolo - dipolo In una sostanza polare le molecole hanno momenti dipolari permanenti per cui tendono ad allinearsi con lestremità positiva di un dipolo diretta verso lestremitànegativa del dipolo vicino. Teoria dellorbitale molecolare MO La formazione della molecola genera ORBITALI MOLECOLARI che derivano dalla fusione degli ORBITALI ATOMICI. Ne sono esempio lacqua H2O lammoniaca NH3 e il fluoruro di idrogenoHF.
Nella molecola non polarizzata il baricentro delle cariche positive coincide con il baricentre delle cariche negative.
Questa interazione si verifica a causa di interazioni elettrostatiche tra ioni e dipolo. Le forze intermolecolari 2. Forze di Van der Waals Forze di attrazione ione-dipolo Spiegano la solubilità delle sostanze saline in acqua e nei liquidi polari. Legame dipolo - dipolo In una sostanza polare le molecole hanno momenti dipolari permanenti per cui tendono ad allinearsi con lestremità positiva di un dipolo diretta verso lestremitànegativa del dipolo vicino.
 Source: pt.slideshare.net
Source: pt.slideshare.net
Interazioni di Van der Waals. Le forze intermolecolari 2. Molecole polari e apolari 3. Sono forze generalmente deboli 3-10 kJmol Generalmente solubili in acqua con la quale formano interazioni dipolo dipolo. Legame a idrogeno Legami dipolari.
 Source: youtube.com
Source: youtube.com
Legame dipolo-dipolo legame a idrogeno o raramente legame dipolo-dipolo indotto. I legami intermolecolari posso essere di tre tipologie. Il legame sarebbe stato. Interazioni di Van der Waals. Legame dipolo-dipolo legame a idrogeno o raramente legame dipolo-dipolo indotto.
 Source: calameo.com
Source: calameo.com
B Attrazione permanente dipolo-dipolo. Le forze intermolecolari 2. LEGAME DIPOLO-DIPOLO Il legame dipolo-dipolo si stabilisce tra la parte positiva di una molecola polare e quella negativa di unaltra molecola polare. A Attrazione istantanea dipolo-dipolo. Interazioni ione-dipolo Lenergia media V di interazione fra uno ione avente carica q e un dipolo permanente ad una distanza r 2 4 0 r q V dove il segno negativo indica che linterazione attrattiva.
This site is an open community for users to do submittion their favorite wallpapers on the internet, all images or pictures in this website are for personal wallpaper use only, it is stricly prohibited to use this wallpaper for commercial purposes, if you are the author and find this image is shared without your permission, please kindly raise a DMCA report to Us.
If you find this site beneficial, please support us by sharing this posts to your favorite social media accounts like Facebook, Instagram and so on or you can also save this blog page with the title legame dipolo dipolo by using Ctrl + D for devices a laptop with a Windows operating system or Command + D for laptops with an Apple operating system. If you use a smartphone, you can also use the drawer menu of the browser you are using. Whether it’s a Windows, Mac, iOS or Android operating system, you will still be able to bookmark this website.





